考古科学中心在SCLS发表大人群基因组测序时代背景下线粒体基因组研究新范式及研究进展综述

2024年9月17日,四川大学考古科学中心、四川大学华西医院罕见病研究院的袁慧军教授/何光林副研究员团队,联合广东省毒品实验技术中心(国家毒品实验室广东分中心)的刘超院士研究团队,以及重庆医科大学基础医学院的唐任宽教授团队,在《SCIENCE CHINA Life Sciences》上发表了题为“Sequencing and characterizing human mitochondrial genomes in the biobank-based genomic research paradigm”的综述论文。该研究系统地综述了在大规模生物样本库支持下的人类基因组学研究新范式中,人类线粒体DNA(mtDNA)研究的最新进展,包括mtDNA异质性、母系遗传模式、父系遗传争议、细胞核-线粒体DNA片段(NUMTs)、线粒体DNA调控机制、线粒体疾病新机制以及线粒体数据库的构建。研究强调了下一代测序技术(NGS)和大规模mtDNA数据资源在分析mtDNA变异、探索NUMTs功能以及理解mtDNA在人类进化中的关键作用,并展望了跨学科合作在推动人类遗传学领域研究中的重要性,同时指出了第三代测序技术(TGS)和人工智能在基因组研究中的潜力。

本综述聚焦于mtDNA研究的三个激动人心的领域:线粒体异质性的图谱、NUMTs的分布与影响,以及mtDNA的遗传多样性和母系演化历史。随着下一代测序技术(NGS)的发展、人类基因组计划的推进以及大样本量生物数据库的建立,我们对mtDNA相关科学问题的理解不断得到修正和精进。例如,线粒体异质性在正常人体中的广泛存在及其遗传模式,NUMTs的分布和产生过程,以及mtDNA变异位点在追溯早期人类迁徙和理解地区人类生物适应性中的关键作用。最后,本综述展望了在TGS快速发展和基因组数据大量产生的背景下,多学科交叉合作将如何深化我们对mtDNA在精准医疗、遗传病学和人类演化历史研究中作用的认识,为解决临床医学和人类学中的长期难题提供新的视角和方法。
线粒体是细胞的能量工厂,而mtDNA编码了氧化磷酸化系统的关键蛋白,对调节氧化呼吸和生命活动中具有重要的作用。一个细胞中存在多个mtDNA拷贝数,而这些mtDNA的类型可能不同,被称为线粒体异质性。变异的mtDNA可能导致线粒体功能障碍,进而引起多种代谢性和退行性疾病。越来越多的证据表明,线粒体的异质性普遍存在,且对人体的生理功能有复杂的影响。另外,mtDNA与细胞核DNA(nDNA)存在多种互动,而NUMTs则是细胞水平遗传物质转移的直接证据。此外,mtDNA的母系遗传和较高突变率的特性使其成为研究人类起源、迁徙模式的有力工具,有助于回答人类迁徙历史的关键问题。
MtDNA对于理解细胞能量代谢、众多人类疾病和进化动态至关重要。与nDNA不同,mtDNA是母系遗传的,具有更高的突变率,并承担着独特的功能,为我们提供了洞察生物学基本过程的独特视角。尽管mtDNA的结构简单,但它编码了十四个位于氧化磷酸化系统(OXPHOS)中的关键蛋白,这些蛋白对于人体代谢中的能量转换至关重要(图1a-b)。而这些编码基因的突变可能导致线粒体功能障碍,从而减少ATP产生并增加活性氧物质。这些变化是各种代谢和退行性疾病的特征。mtDNA在疾病研究中具有广泛的重要性,既涉及由直接mtDNA突变引发的线粒体疾病,也包括与间接线粒体功能障碍相关的复杂疾病。线粒体疾病(MDs)表现出多样的症状和遗传模式,强调了mtDNA在细胞健康中的作用。而异质性的存在增加了疾病表型和遗传的复杂性,为遗传和临床研究带来挑战。另一方面,mtDNA也是研究人类起源和迁移模式的强大进化工具,因为它是母系遗传的,且没有重组(图1d)。其较高的突变率已作为分子钟(图1c),在重建系统发育关系和人类人口历史方面发挥了巨大作用。此外,大规模生物数据库的出现和测序技术的进步促进了mtDNA的研究。生物数据库的高质量生物样本,为全面的mtDNA研究提供了必要的遗传材料。同时, NGS和TGS技术使得mtDNA的快速、高分辨率测序和分析成为可能,允许更精确地表征其在不同人群和疾病中的变异。生物银行和先进测序技术的这种协同作用标志着基因组研究范式的转变,增强了我们对mtDNA在健康、疾病和人类历史中作用的理解(图2)。
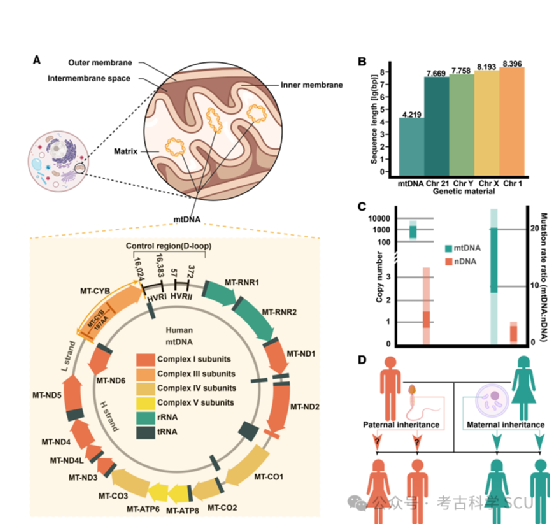
图 1 MtDNA的结构和遗传特征。
MtDNA异质性图谱
线粒体DNA异质性可以分为长度异质性和序列异质性(图3a-b)。长度异质性通常由插入/缺失(InDels)或复制引起,会改变mtDNA分子的长度;而序列异质性则涉及同一体内核苷酸序列的变化,主要是单核苷酸变异(SNVs)。这些变异可能源于内部因素,如DNA复制不匹配,或外部因素,如紫外线、放射性辐射、化学物质和某些病毒。研究表明,年龄与异质性之间存在相关性,动物研究也发现了异质性中的性别偏见现象。这些发现引发了关于哪些异质性由遗传获得、哪些异质性与细胞增殖和分化相关,以及异质性受核DNA调控程度等问题的讨论。既往研究确定,生殖细胞中严重和致病的mtDNA突变主要是母系遗传的,尽管它们也可以是新发生的。然而,新发生突变的复发风险较低,这强调了产前咨询的关键作用。
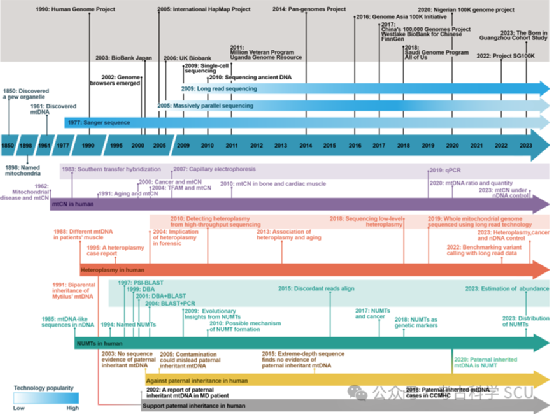
图 2 MtDNA研究和技术进步的时间轴
最近的研究填补了我们对mtDNA异质性理解的空白。Gupta等人分析了英国的UK Biobank和美国的All of Us数据集中约30万人的异质性,发现异质性SNVs随年龄积累并倾向于体细胞起源,而异质性InDels是母系遗传的。此外,全基因组关联研究揭示了多个核基因参与调控异质性水平。MtDNA异质性在MDs的发病中也至关重要,其发病机制与nDNA变异显著不同。尽管许多mtDNA突变位点与MDs相关,但在诊断期间仍需考虑阈值效应。该效应指的是异质性mtDNA突变需要达到一个临界水平才能破坏线粒体功能并引发疾病症状,这一临界水平会显著影响线粒体疾病(MDs)的发病及其严重程度(图3b)。阈值在个体间并不统一,受突变类型、位置和不同组织的能量需求等因素影响。因此,一些具有高水平异质性突变的个体可能是无症状的,而其他具有较低水平的个体则表现出症状。了解阈值效应对于准确诊断MD并阐明遗传变异与线粒体功能之间的关系至关重要。
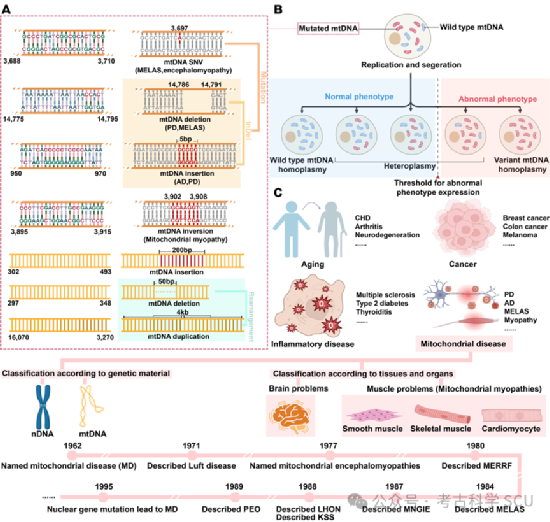
图 3 MtDNA变异类型和线粒体疾病分类
研究已将异质性水平与多种疾病联系起来,包括2型糖尿病、中风和高血压(图3c)。在许多癌症中,异质性变异累积。异质性的临床表现可能会掩盖遗传基础,使MDs的诊断变得复杂,并延迟治疗。因此,了解人群水平的异质性分布和遗传模式是必要的。异质性水平可以相对定义(突变mtDNA与总mtDNA的比例)或绝对定义(突变mtDNA的数量),大多数研究关注前者。以前认为,非同义异质性突变可能存在于健康个体中,但致病性异质性不应该存在。然而,这种观点已经改变。一项关键的研究表明,有1/192的个体携带致病性变异而没有明显的临床症状。单细胞测序和大规模人群基因组数据揭示了个体细胞内异质性的动态波动。这些研究表明,异质性可以在健康个体中被检测到,因此MDs与异质性具有复杂的联系。
这种感知范式的转变在很大程度上归功于NGS技术的快速发展。最早的Sanger测序方法因为其通量低、成本高等局限性,在完整的线粒体基因组测序中的应用有限。因此,早期的mtDNA测序主要关注高变区域I(HVR I:16024-16383)和II(HVR II:57-372),忽略了高GC含量和二级结构域的区域。这降低了测序分辨率,阻碍了个体间遗传差异的准确检测以及同一个体内异质性的探索。尽管NGS容易出现假阳性或假阴性,但其高通量特性和扩展的读取范围提高了数据密度,允许对整个线粒体基因组进行更细致的测序,并促进了低水平异质性的检测。Guo等人在母子对中识别了变异的遗传模式和瓶颈效应。随后的研究采用了各种质量控制方法,逐渐将异质性水平的检测限降低到1%甚至0.5%以下。值得强调的一个领域是研究低频异质性突变与衰老和生殖障碍的关系。异质性突变与衰老之间的关系虽已得到部分阐明,但仍有许多复杂机制有待理解。总之,对mtDNA异质性的深入研究不仅有助于我们理解人类遗传多样性,还能推进精准医学和个性化医疗的发展,促进早期疾病诊断和预防。虽然需要更多的实验验证,但目前的研究已为我们的科学探索提供了新的视角。
NUMTs的模式和功能
在人类的细胞核中,隐藏着一类特殊的DNA序列——NUMTs。它们与mtDNA序列高度相似,却存在于细胞核中。这些序列的发现,让我们对细胞内部的基因交流有了更深的认识。NUMTs的起源可以追溯到1967年,当时通过杂交实验首次发现了核基因组中的mtDNA样序列。直到1994年,Lopez等人通过测序和比较,正式将这些片段命名为NUMTs。一个复杂而引人入胜的问题随之而来:mtDNA是如何整合到核基因组中的?线粒体在经历分裂、融合、膨胀、收缩、碎裂和自噬等形态变化过程中,可能会泄露mtDNA到细胞质中,进而导致mtDNA片段转移到核基因组中(图4a-b)。一些研究表明,mtDNA与nDNA之间的相互作用可能与nDNA双链断裂(DSBs)的修复有关。目前普遍认为,NUMT的形成与非同源末端连接(NHEJ)途径密切相关(图4b)。
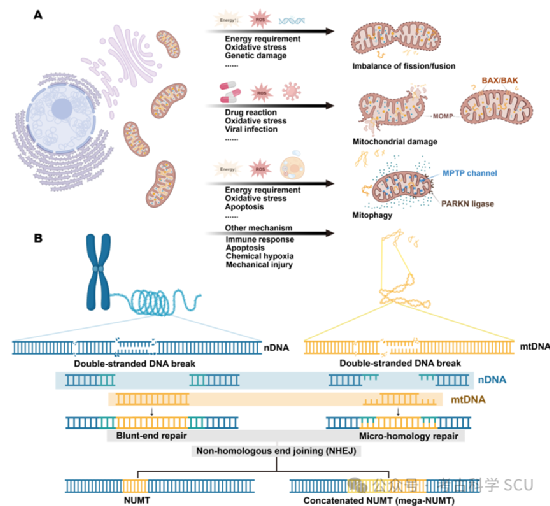
图 4 NUMTs的形成机制
准确识别NUMTs至关重要,因为将它们误认为是mtDNA异质性可能导致MDs的误诊和异质性变异的不可靠解释。区分NUMTs和mtDNA异质性的方法可以分为湿实验方法和计算分析方法,两者各有优劣。。湿实验方法,如线粒体分离和针对NUMTs的PCR引物设计,提供直观和准确的结果。然而,这些技术昂贵且耗时,可能无法捕获NUMTs的全部多样性。因此,计算方法更常用。早期方法利用基本局部比对搜索工具(BLAST)检测和排除与mtDNA序列相似的nDNA序列。研究人员后来采用了k-mer的分布和频率来识别潜在的NUMTs。当前研究常结合多种生物信息学工具,创建个性化、高效和灵活的工作流程。然而,计算方法容易出现假阳性和假阴性,因此使用统计措施,如mtCN、变异等位基因频率和质量评分来验证结果是至关重要的。
NUMTs在真核生物基因组中普遍存在,片段长度和数量在不同物种间存在变异。一些NUMTs源自整个线粒体基因组,表明线粒体DNA和核DNA之间存在复杂的相互作用。最初,NUMTs被认为是约20亿年前古老内共生过程的遗迹。然而,最新的研究显示,NUMTs的出现贯穿了整个人类进化过程,这一发现表明了一个重要的细胞内基因转移途径,并增强了我们对内共生假说的理解。此外,大多数NUMTs是非功能性的,主要位于基因组重复区域、调控元件、短散在核元件(SINEs)、简单重复序列和内含子中。NUMTs很少发现在编码区域或基因转录起始位点500 bp内。这种分布可能源于DSB修复的位点特异性或对编码区域的显著选择压力。研究还揭示了基因不耐受评分和NUMTs频率之间的负相关性,表明靠近基因的NUMTs可能受到强烈的进化选择压力,以维持基因结构和功能稳定性。
尽管NUMTs主要是非功能性的,但了解它们在不同人群中的分布和动态变化对于防止MDs的误诊以及理解疾病和癌症具有重要意义。NUMTs的片段长度和数量在不同人群中存在差异,可能反映了不同遗传背景下的进化历史。一些研究表明,某些NUMTs与肿瘤发生密切相关,可能表明极端条件,如癌细胞增殖,可以触发NUMT形成或遗传重排。例如,FUS-DDIT3基因,由涉及NUMT插入的复杂重排产生,存在于90%的粘液性脂肪肉瘤中,突出了NUMTs的致癌作用。深入研究NUMTs对于揭示细胞内基因转移的关键途径、提供内共生理论的新见解以及理解人类及其祖先的遗传变异和适应进化至关重要。
父系遗传模式的意外发现
传统上,mtDNA被认为是严格母系遗传的,即个体从母亲那里继承mtDNA。然而,一些研究提出了mtDNA可能存在父系遗传的证据。1991年,Gyllensten等人基于对近交小鼠品系的实验,提出了mtDNA可能通过父系遗传的观点。随后,在果蝇、蜜蜂、蝉、鸡、羊和克隆牛中也观察到了类似的发现,这促使科学家们进一步研究人类mtDNA的遗传模式。Luo等人对多个家族中的多代人进行了mtDNA测序,发现高异质性水平的mtDNA,并提出了mtDNA的双亲传递,且传递模式类似常染色体显性遗传模式的可能性。这一发现为人类mtDNA的父系遗传提供了证据,但也为理解MDs带来潜在的复杂性。然而,许多研究未能重复这些发现,导致对该领域的怀疑。Pyle等人在研究中利用约120万倍覆盖深度的三联体mtDNA序列数据,,未发现父系传递的证据。随着NGS时代NUMTs研究的进步,关于人类mtDNA父系遗传的争论逐渐达成共识。作为nDNA的一部分,NUMTs遵循常染色体遗传模式,这使得早期测序结果复杂化,并导致了关于父系遗传的错误结论。短读长可能导致组装困难,降低映射准确性,并阻碍NUMTs的识别。因此,优化的NUMTs检测流程和高覆盖率WGS数据,尤其是来自PacBio SMRT或Oxford Nanopore技术的数据,对于区分NUMTs和真正的mtDNA变异至关重要。
母系进化历史与mtDNA的遗传多样性
人类社会新石器时代农业创新以来,生业模式及从夫居或从母居的定居模式等显著影响了人类群体的父系和母系精细遗传背景及形成模式。进化历史对于理解人类不同语言和民族群体的起源、迁移、混合和遗传多样性模式至关重要。mtDNA,作为一种古老且母系遗传的标记,随着时间的推移积累了足够的突变,可以用来区分遗传上不同的群体。这些突变的位置和数量可以确定群体间的差异,从而阐明群体之间的系统发育关系。1987年,Cann等人对全球147个个体的370个mtDNA限制位点进行了测序和分析,揭示了现代人类最近的共同母系祖先,即“线粒体夏娃”,起源于非洲的一个小群体。尽管这项研究为现代人类在不同大陆的遗传构成提供了广泛概述,但缺乏对不同地理区域人群遗传结构的详细了解。HVRs富含突变,却只占线粒体基因组的一小部分,使得局部测序不足以重建详细的系统发育关系并探索人群间的精细尺度的遗传结构。NGS技术的发展解决了这些挑战,使我们能够发现并更深入地理解遗传多样性。例如,早期的靶向测序数据表明,单一的非洲外迁事件使人类定居澳大利亚和欧亚大陆,原因在于这些地区三大宏单倍群(M、N和R)的最近共同祖先时间相似。然而,全基因组测序揭示了澳大利亚土著人和欧亚人群之间的分化时间存在显着差异,分别大约在 7万年前和 3万年前,反驳了早期的假设。
完整的mtDNA测序还强调了现代人类从非洲沿“南线”迅速迁移到亚洲的过程。随后的研究将这一路线细化,包括从中国南部到喜马拉雅地区的扩张,以及从东南亚沿河流系统进入东亚。此外,对巴基斯坦北部和周边人群的19,568个mtDNA序列的全基因组测序阐明了Yamnaya相关的草原人群对南亚人群的遗传影响,以及东北亚、日本和美洲土著人群母系祖先之间的深层次联系。多项研究详细描述了人类的迁移历史,并阐明了通过复杂人群混合过程形成的遗传多样性。例如,中国西藏藏族人群的全mtDNA序列证实了他们的组成包括旧石器时代母系人群和来自黄河流域的新石器时代粟作农业人群,完善了先前的考古观点,从母系遗传标记角度实证了汉藏共同起源。同样,中国南方和东南亚的土著人群都存在古老的遗传成分以及自全新世以来新形成的遗传成分。总的来说,全基因组测序在回答人类历史方面具有重要的优势。
从进化角度看人类疾病和表型变异
从进化的角度来看,人类的疾病和表型变异,是复杂生物系统在适应多变环境的过程中,由自然选择引发的约束、权衡、错配与冲突共同作用的结果。本文旨在通过研究线粒体DNA突变来阐述这一观点。当我们分析定义不同单倍型的突变时,便引出了一个引人入胜的问题:这些突变是否导致了功能上的差异,并进一步影响了个体在特定环境下的适应或疾病?这些因素如何影响当前人群的地理分布?一些研究试图回答这个问题。对mtDNA编码区的非同义和同义突变的研究表明,ATP6、细胞色素b和细胞色素c氧化酶I(在OXPHOS中起重要作用的基因)在不同纬度的人群中表现出显著的功能差异,表明突变与遗传多样人群的分布之间可能存在联系。具体来说,单倍群M和N在亚洲占主导地位,北方单倍群N的两个氨基酸变异(ND3和ATP6)改变了线粒体膜电位和Ca2+水平,影响了耦合效率并增加了产热,这可能在寒冷环境中提供了适应优势。研究表明,流行于西伯利亚的单倍群A、C和D比单倍群B和F具有更高的基础代谢率。MDs也显示出独特的分布模式。例如,与位置11778或14484的突变相关的Leber遗传性视神经病变(LHON)在欧洲广泛分布的单倍群J中,比在其他单倍群中具有更高的疾病风险。此外,在单倍群U和J的遗传背景下,位置16126和73的突变更可能导致年龄相关的黄斑变性和视网膜色素问题。尽管东亚人群中与单倍型N9a相关的心肌梗死风险更高,但它也与糖尿病风险降低相关。在汉族人群中,单倍群M7b1a1与较低的BMI、腰围和腰臀比相关,表明肥胖风险降低。然而,它也导致总胆固醇和低密度脂蛋白胆固醇水平升高。
测序进展、基因组数据库和分析技术
准确识别个体异质性水平、阐明NUMTs的形成机制、重塑进化历史以及推进个性化医学和精准治疗,都依赖于生物数据的收集、存储和分析。这向测序技术、数据库和计算方法方面提出了挑战。NGS带来的范式转变显著增强了我们对上述科学问题的理解,但NGS仍然有局限性。区分真正的异质性变异和由NUMTs引起的假阳性仍然具有挑战性。例如,PCR扩增DNA样本可能会引入偏差,影响低水平异质性的敏感性。此外,NGS产生的短读长不利于一次性测序整个线粒体基因组,也不利于识别长NUMTs或复杂基因组区域中的变异。这在许多NUMTs存在的情况下使得准确映射变得复杂,并可能导致潜在错误。相比之下,TGS尽管存在一定的局限性,但其提供了更长的读长,无需PCR扩增,提高了检测低水平异质性、结构变异和NUMTs的准确性。为了充分利用TGS技术,必须解决两个迫切需求:建立包含不同语言和民族群体和全面疾病谱的高质量基因组生物数据库,以及开发优化的算法,快速准确地识别异质性和mtDNA变异以及NUMTs。
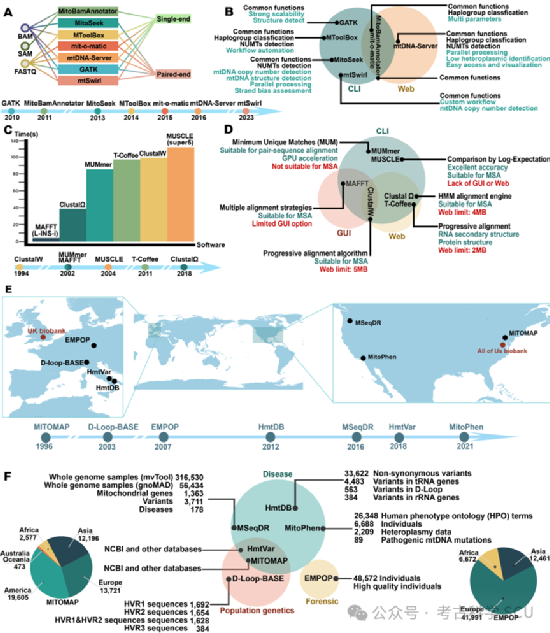
图 5 MtDNA数据库和分析工具的特点
在基因组时代,处理和分析产生的大量数据成为一个日益严峻的问题(图5e-f)。分析如此庞大的数据量需要大量的计算资源和复杂的生物信息学工具。一个关键挑战是比对可变长度的序列,目前已有许多研究开发了多个工具和流程(图5c-d)。通常,所有软件程序都进行碱基质量评估、读长比对和异质性水平计算。我们总结了一些当前流行的工具,指出了它们的局限性。例如,MitoBamAnnotator只接受单端序列输入,可能会错过其他DNA链上的异质性数据(图5a-b)。尽管mit-o-matic具有Web和命令行(CLI)界面,能够满足多样化的分析需求,但它受到过多参数选项的影响,常常导致次优和不可靠的结果。此外,通过CLI使用各种软件的集成流程需要手动配置全面的运行时环境,这提出了重大挑战,并降低了数据传输、分析和解释的效率。
尽管目前的研究在构建高质量生物数据库和开发相应软件方面取得了显著进展,但该领域仍面临众多挑战。这些挑战包括因技术限制而导致的大规模基因组数据中的噪声或信息丢失的解释与管理,以及将遗传信息与复杂的现实环境相结合的难题。人工智能(AI)为这些挑战提供了有希望的解决方案。作为AI的一个分支,机器学习使计算机能够通过从数据和算法中学习来提高数据处理的效率和准确性,而无需显式编程。这包括用于自动识别数据分布模式的技术,这些技术可以用于预测或决策。深度学习技术在识别复杂数据中的模式和信号方面展现出巨大潜力。例如,Min等人使用深度学习方法分析人类基因组数据,并成功预测了各种复杂疾病的遗传风险。Angermueller等人通过深度学习模型分析基因表达数据,准确识别了与特定疾病相关的表达模式。Poplin等人开发了一种使用深度学习方法的高精度变异检测工具,从高通量测序数据中识别SNVs和InDels,为遗传研究和变异解释提供了有效手段。此外,集成学习方法可以通过组合多个模型来提高预测准确性和鲁棒性。另外,提高算法的可解释性是研究的另一个关键方向。开发能够处理异质数据并考虑遗传信息与现实世界之间相互作用的模型对于解决复杂生物系统中的问题具有重要的意义。未来,AI将在解释遗传信息、推进个性化医学和理解人类疾病遗传基础方面发挥越来越重要的作用,而实现这些目标需要计算科学和遗传学之间的跨学科合作。
结论和展望
本综述重新审视了NGS技术促进的医学科学和进化基因组学中mtDNA研究的最新进展。我们强调了异质性对线粒体功能的影响及其与MDs的关联,以及NUMTs在挑战传统mtDNA遗传观念和增强我们对内共生假说理解中的作用。此外,我们强调大规模人群mtDNA研究揭示了人类广泛的迁移路径和对不同环境的适应,塑造了我们当前的母系遗传结构。本文还考察了当代计算工具的特点,并强调这些工具改进了多序列比对,提高了变异识别的准确性,并深化了我们对结构与功能之间关系的理解。这些进展完善了我们对mtDNA变异在生物学过程中所扮演角色的知识。最后,我们强调建立一个包含常见和罕见的遗传变异的全面、高质量、可访问的mtDNA数据库的重要性。
TGS技术,因其长读长、单分子测序和高分辨率结构变异检测的能力,对于实现我们的研究目标至关重要。这种方法有助于检测极低水平的异质性,并增强NUMTs分布的识别,丰富我们对MDs和mtDNA遗传模式的理解。此外,TGS识别mtDNA化学修饰的能力可能揭示表观遗传变化,为TGS对线粒体功能和细胞代谢的影响提供了见解。这将进一步扩大了我们对MDs、遗传学和环境因素之间相互作用的理解。
TGS的广泛应用对于人类泛基因组项目的任务至关重要,该项目旨在绘制所有人类遗传变异,包括不同人群共享的核心基因组、特定个体中发现的附属基因组和每个人特有的唯一基因组。这个项目超越了单参考基因组研究的局限性,使我们能够更全面地捕获遗传变异,特别是罕见变异、结构变异及其对表型的影响。通过比较附属和唯一基因组,我们可以追溯变异的出现和传播,阐明个体如何通过基因的增加、丢失或修改来适应环境变化。这一过程将揭示群体内部复杂的遗传结构,阐明群体间的遗传差异和进化路径,为疾病诊断和个性化医学提供了宝贵的资源。基于泛基因组的跨群体和物种分析可能会揭示重要的细胞核-线粒体的相互作用机制,并促进对内共生和NUMTs动态和机制的更深入探索。总之,我们预计未来人类遗传研究的突破将彻底改变医学研究、疾病管理和人类学调查。实现这一目标需要进化基因组学、生物信息学、计算机科学等领域的跨学科合作,以克服样本偏见、数据处理和分析方面的挑战。
综上所述,该研究从如下三个主要的方面阐述了mtDNA近年来激动人心的研究:线粒体异质性图谱,NUMTs的分布与影响,mtDNA的遗传多样性和母系演化历史。NGS的发展,人类基因组计划的推进和大样本量的生物数据库的建立不断修正和精进我们对mtDNA相关科学问题的理解。并且该研究提出,在TGS快速发展和基因组数据大量产生的背景下,多学科(尤其是人工智能领域)的交叉合作,将深化我们对mtDNA在精准医疗、遗传病学和人类演化历史研究中的作用的认识,为解决临床医学和人类学中的长期存在的难题提供新的视角和方法。
四川大学考古科学中心/四川大学华西罕见病研究院袁慧军教授、何光林副研究员和王萌鸽博士、重庆医科大学基础医学院唐任宽教授为共同通讯作者。重庆医科大学罗林焘硕士研究生、刘运辉硕士研究生,四川大学考古科学中心/四川大学华西罕见病研究院何光林副研究员、王萌鸽博士为共同第一作者,相关工作得到国家自然科学基金、四川大学考古科学中心开放课题、国家社会科学基金重大专项、四川大学华西医院1.3.5等项目的资助。
